Il Collagene idrolizzato nella prevenzione e nel recupero infortuni
Il collagene (COL) è caratterizzato da un’alta concentrazione di tre aminoacidi; glicina, prolina ed idrossiprolina, che conferiscono la caratteristica struttura dalla forma a tripla elica; il COL costituisce circa un terzo del contenuto totale di proteine presenti nell’organismo umano ed è la più abbondante forma strutturale di proteine del corpo. Il ruolo primario della supplementazione di COL è quello di mantenere il tessuto connettivo presente nell’organismo in salute, salvaguardandone le proprietà meccaniche [1].
Il COL quando assunto nella sua forma naturale viene idrolizzato da alcuni enzimi per produrre peptidi bioattivi più piccoli (la forma primaria di collagene) che vengono facilmente assorbiti dal tratto digerente prima di entrare in circolo; per via dell’idrolisi, i peptidi di COL non possiedono le proprietà gelificanti della gelatina e diventano solubili in acqua fredda [3]. Attualmente, le fonti alimentari di peptidi del collagene provengono da bovini, porcini e pollame, ognuna di queste sottoforma idrolizzata [2].
La ricerca sui peptidi del collagene e sui prodotti specifici della gelatina si è principalmente concentrata sull’impatto della supplementazione sulla salute delle ossa e delle articolazioni, per via del suo ruolo nel regolare il turnover articolare, tendineo e osseo [4, 5]. Esiste una cospicua evidenza scientifica che conferma l’efficacia dell’assunzione di COL nell’inibire il catabolismo del collagene osseo e alleviare i sintomi del dolore associati alla condizione degenerativa delle articolazioni tipica dello sportivo [6]. Due review sistematiche hanno concluso che l’utilizzo del COL è sicuro e che esso può essere considerato un supplemento terapeutico utile nel gestire i sintomi associati all’osteoartrite sia nello sportivo che nella popolazione generale [7, 8].
Meccanismo d’azione del Collagene idrolizzato
Due studi hanno valutato l’effetto del COL sulla sintesi del collagene nell’organismo umano, in forme e dosi differenti, mentre altri due hanno investigato sull’effetto del collagene quando confrontato con l’assunzione di proteine di diverse forme sulla sintesi proteica muscolare (MPS) [9-12]. Shaw e colleghi hanno osservato un aumento significativo nei marker della sintesi di collagene (N-terminal peptide of procollagen- PINP) a seguito dell’introduzione di 15g di COL arricchiti con vitamina C (0 ng/ml vs 30ng/ml livelli di PINP dopo 4h) consumate 60 min prima dell’esercizio fisico [12].
Altri due studi hanno osservato un’aumentata sintesi proteica muscolare dopo l’assunzione di proteine del siero del latte (whey) e lattoalbumina, inferiore all’assunzione del solo COL [11, 13]. Lo studio di Shaw e colleghi ha fatto luce sull’efficacia dell’assunzione di collagene e vitamina C nell’aumentare la concentrazione dei singoli componenti del collagene nel siero dell’uomo [14]. L’aumento di questi livelli sierici un’ora dopo aver consumato gelatina (costituita da COL) ha portato ad un incremento del contenuto di collagene e della resistenza meccanica in un legamento ingegnerizzato [14]. Questo tipo di legamenti mostravano un aumento della resistenza meccanica quando veniva somministrato il collagene, ma solo quando veniva assunta contemporaneamente la vitamina C vi era un incremento nel contenuto di collagene articolare; ciò probabilmente per via del suo ruolo nell’idrossilazione della prolina e della lisina, entrambi essenziali per la formazione dell’ellisse di collagene e del reticolo intermolecolare [14, 15]. La bevanda Ribena utilizzata in questi studi era naturalmente ricca in vitamina C (48.5 mg in 80 mL); anche se non sono state misurate le concentrazioni di vitamina C sieriche, è possibile che questa componente dell’integrazione abbia avuto un effetto positivo sulla meccanica dei legamenti, vista l’attività della vitamina C [16].
In un altro studio, i soggetti che consumavano alti quantitativi di gelatina un’ora prima dell’esercizio del salto della corda per sei minuti consecutivi mostravano il doppio della sintesi di collagene rispetto ad un gruppo che assumeva placebo, o ad un altro gruppo che integrava con un basso contenuto di gelatina [14]. Inoltre, la supplementazione con gelatina ha mostrato un miglioramento nella struttura del tessuto connettivo e della sua funzione [14]. Mc Alindon e colleghi hanno scoperto che il consumo di 10 grammi di collagene idrolizzato al giorno portava ad un aumento della sintesi di collagene all’interno delle ginocchia [17]. I dati attuali, dunque, supportano fortemente l’ipotesi che iniziare l’esercizio 1 ora dopo aver consumato dai 10 ai 15gr di gelatina possa portare ad una sintesi maggiore di collagene nel periodo di recupero post esercizio [18, 19]. In modo simile al muscolo scheletrico, il sistema tendineo mostra alte capacità di plasticità quando esposto ad un carico meccanico.
Studi sull’efficacia del collagene nello sportivo
Visto l’incremento della prevalenza di infortuni a lungo termine sulle articolazioni e l’aumentata incidenza di osteoartrite negli sportivi, esiste un crescente interesse sugli interventi terapeutici per migliorare la salute articolare in questa popolazione di individui. Diversi studi avevano lo scopo di provare l’efficacia di alcuni protocolli di esercizio combinati all’utilizzo di COL, per poi misurare l’impatto dell’attività fisica intensa sulla funzionalità articolare ed il recupero [20]. E’ probabile che l’esercizio sia coadiuvante l’effetto benefico del COL per via dell’ipotesi della meccano-trasduzione, che propone come il carico meccanico sul tessuto tendineo durante l’esercizio crei dei segnali a cascata all’interno delle cellule tissutali, con conseguente risposta nella sintesi di nuova matrice proteica e successiva ipertrofia tendinea [21].
Dato che il collagene è il componente principale della matrice extracellulare (ECM) esso è fondamentale per la forza, la regolazione e la rigenerazione dei tessuti connettivi [22]. Il collagene contribuisce a circa il 65-80% del peso secco dei tendini, con i reticoli di collagene che conferiscono alla struttura tendinea la capacità di resistere ad alti stressor e forze di taglio [23]. Per le ragioni esposte, la supplementazione di collagene potrebbe svolgere un ruolo vitale nel mantenimento della salute tendinea e nel mitigare il rischio di infortuni nello sportivo [24].
Jerger e colleghi hanno investigato sull’effetto della supplementazione di peptidi specifici del collagene (SCP) nella misura di 5gr in combinazione con l’allenamento contro resistenza (RT) ad alta intensità sul cambiamento delle proprietà strutturali del tendine patellare rispetto ad un placebo; è stata misurata, inoltre, la stiffness tendinea, la forza massima volontaria dell’estensione del ginocchio e la sezione trasversa muscolare (CSA) del retto femorale tramite risonanza magnetica (MRI) [25]. I soggetti selezionati in questo studio erano 50 uomini fra i 18 ed i 40 anni praticanti attività fisica moderata che non hanno assunto integratori nei 6 mesi precedenti; i partecipanti sono poi stati suddivisi fra il gruppo controllo ed il gruppo placebo in maniera casuale [25]. I soggetti dello studio hanno poi svolto per 14 settimane tre sessioni di allenamento basate su leg press, leg extention e calf raise ciascuno per 3 set a carico crescente nelle settimane [25]. Nel gruppo di controllo venivano assunti su base giornaliera 5g di peptidi del collagene, mentre l’altro gruppo assumeva un placebo costituito da maltodestrine [25]. Il basso peso molecolare e l’alta proporzione di prolina e idrossiprolina nei peptidi del collagene portava ad una maggiore efficienza nel trasporto, unita ad una maggiore resistenza alla digestione intestinale, che consentiva ai SCP di avere un’alta biodisponibilità [26, 27]. Nei 31 partecipanti che hanno completato con successo lo studio, l’allenamento contro resistenza ha indotto un incremento della cross sectional area (CSA) che era maggiormente pronunciata prossimalmente e medialmente rispetto al sito di inserzione del tendine muscolare, il potenziamento avveniva lungo l’intero tendine dopo la supplementazione. La CSA del tendine patellare veniva incrementata del 10,7% a seguito dell’effetto stimolante della supplementazione con specifici peptidi del collagene sulla sintesi del collagene, ciò potrebbe diminuire lo stress tendineo e supportarne la guarigione, inoltre, non sono stati segnalati eventi avversi durante le 14 settimane di assunzione [25].
E’ stata svolta una review sistematica sulla supplementazione di COL unita all’esercizio fisico selezionando 15 studi clinici randomizzati che includevano in gran parte atleti amatoriali [28]. Gli outcome degli studi sono stati suddivisi in: dolore articolare e recupero dagli infortuni articolari, composizione corporea, dolore muscolare e recupero dall’esercizio fisico, sintesi proteica muscolare (MPS) e sintesi del collagene [28]. I risultati hanno mostrato che il COL è benefico nel migliorare la funzionalità articolare e nel ridurre il dolore articolare, inoltre sono stati osservati miglioramenti della composizione corporea, della forza e del recupero muscolare a seguito dell’esercizio fisico intenso [28]. Il tasso di sintesi del collagene veniva innalzato dall’assunzione di 15g/al giorno di COL, al contrario non vi era un impatto significativo sulla sintesi proteica muscolare (MPS) quando confrontata con l’assunzione di fonti proteiche di alta qualità e con pari contenuto di azoto [28]. I meccanismi esatti di questi adattamenti restano sconosciuti per cui saranno necessarie ulteriori ricerche e campioni più grandi, atleti d’élite, partecipanti donne e un outcome di misura più preciso, come la biopsia muscolare o la risonanza magnetica.
Altri cinque studi hanno osservato effetti positivi del COL nella riduzione dei fastidi articolari e del dolore del ginocchio, migliorando la funzionalità di caviglia e ginocchio e accelerando il recupero della tendinopatia achillea, tipica manifestazione cronica riscontrabile in diverse attività sportive soprattutto di endurance [29]. In questi studi sono stati somministrati 40mg, 5gr e 10g al giorno di COL; uno di essi è stato condotto per 3 mesi, uno per oltre 4 mesi e 3 studi per più di 6 mesi [29-33]. Zdzieblik e colleghi hanno osservato un effetto moderato del COL nel dolore durante l’attività fisica, un miglioramento nel range di estensione del ginocchio e un aumento della durata dell’esercizio fisico in assenza di dolore [21]. Dressler e colleghi hanno osservato un miglioramento nella stabilità di caviglia durante i 3 mesi di follow up a seguito dell’assunzione di COL [30]. In modo simile, in pazienti con tendinopatia achillea, è stato registrato un aumento nel dato del Victorian Institute of Sports Assessment – Achilles Questionnaire scores nel gruppo che assumeva collagene (12.6 e 17.7 punti), mentre il gruppo placebo mostrava solo un leggero cambiamento [34].
In uno studio sono stati somministrati 3g/al giorno di COL per 6 settimane, mentre in un altro sono stati utilizzati 20g/al giorno di COL per 7 giorni prima dei rispettivi protocolli di esercizio fisico mirati al danno muscolare [35, 36]. È stato osservato un effetto moderato sul recupero percepito, sul discomfort ed un consistente effetto soppressivo sul dolore in movimento a seguito dell’assunzione di COL [35, 36]. In maniera simile, è stato osservato un effetto considerevole sul dolore muscolare dopo l’assunzione di COL nelle 24h e nelle 48h post-esercizio fisico [35, 36]. In accordo con questi risultati, uno studio randomizzato controllo-placebo a doppio cieco della durata di 24 settimane svolto su atleti ha mostrato come l’introduzione di collagene idrolizzato riduceva significativamente il dolore alle ginocchia durante le attività ad alto impatto, grazie alla sua azione anabolica sui tessuti cartilaginei [37]. Sono stati inclusi 147 soggetti che competevano a diversi livelli in vari team sportivi, questi soggetti furono suddivisi in 72 maschi e 75 femmine assegnati casualmente a due gruppi, uno costituito da 73 soggetti che ricevevano 25mL di una formulazione liquida contenente 10g di collagene idrolizzato, l’altro assumeva un placebo costituito da 25 mL di liquido contenente xantano [37]. Parametri come il dolore, la mobilità e l’infiammazione venivano valutati tramite l’uso di una scala visiva durante le 24 settimane di studio [37]. L’outcome primario è stato il netto miglioramento nei parametri di valutazione nella scala visuale dei parametri di dolore, della mobilità e dell’infiammazione nel gruppo che assumeva collagene idrolizzato [37].
Joonsung Lee e colleghi hanno svolto uno studio con lo scopo di investigare sull’effetto della supplementazione di collagene nel cambiamento della struttura morfologica del tendine patellare, delle sue proprietà meccaniche e delle sue proprietà materiali dopo 10 settimane di allenamento stagionale di calcio (che includeva esercizi a corpo libero per la parte bassa del corpo, allenamento pliometrico e di forza) nella squadra U21 di un club di Super League femminile inglese [38]. La supplementazione includeva 30g di collagene idrolizzato e 500mg di vitamina C 3 volte a settimana [38]. In primo luogo è stato scoperto che vi era un maggior incremento della rigidità tendinea nelle giocatrici che consumavano il collagene idrolizzato insieme al loro allenamento rispetto alle giocatrici che ricevevano il placebo. Non è stato osservato un cambiamento nella sezione trasversa tendinea, che suggerisce come il 18% dell’incremento della rigidità veniva spiegato in maniera preponderante dai cambiamenti nelle proprietà materiali e meccaniche tendinee [38]. Questi maggiori cambiamenti nella rigidità tendinea nel gruppo COL rispetto al PLA possono essere dovuti ad un aumentato carico meccanico che ha indotto una maggiore sintesi di collagene grazie alla presenza di alte concentrazioni sieriche degli aminoacidi necessari (glicina, prolina ed idrossiprolina) unita ad una buona concentrazione di vitamina C (necessaria alla sintesi di collagene) (Fig. 1) [38]. Questi aminoacidi chiave potrebbero aver incrementato la concentrazione di specifici composti (idrossilisile e piridinolina) e/o aver incrementato la densità fibrinolitica di collagene, entrambi hanno il potenziale di incrementare la rigidità tendinea in assenza di ipertrofia tendinea [38].
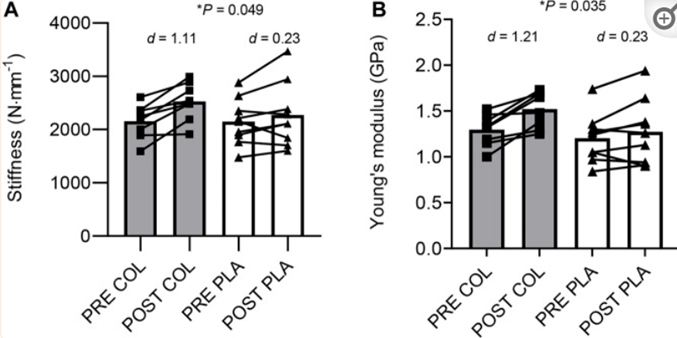
Fig. 1 – Cambiamenti nella stiffness tendinea sia nel gruppo collagene (COL) che nel gruppo placebo (PLA) prima (PRE) e dopo (POST) allenamento [38]
In conclusione, l’analisi di questi studi dimostra che la supplementazione di gelatina, come concentrato di collagene idrolizzato, aumenta la sintesi di collagene articolare dopo l’esercizio fisico e che l’atleta può quindi beneficiarne. La sintesi accelerata di collagene veniva osservata già dopo la prima assunzione di gelatina, ed è stata mantenuta per tutto il tempo delle 72 ore dello studio. Questi dati suggeriscono che l’integrazione di gelatina e vitamina C durante gli allenamenti ad alto impatto articolare (calcio, rugby, pesistica, tennis) potrebbe contribuire alla prevenzione ed al recupero dagli infortuni; inoltre, potrebbe potenzialmente prevenire gli infortuni tendinei da overuse che sono la conseguenza di micro lesioni accumulate a seguito di carico eccessivo e frequente come accade nelle attività di endurance di lunga durata.
BIBLIOGRAFIA
- Ricard-Blum S (2011) The collagen family. Cold Spring Harb Perspect Biol 3(1):a004978. https:// doi. org/ 10. 1101/ cshpe rspect. a0049 78
- Leon-Lopez A, Morales-Penaloza A, Martinez-Juarez VM, Vargas- Torres A, Zeugolis DI, Aguirre-Alvarez G (2019) Hydrolyzed collagen-sources and applications. Molecules. https:// doi. org/ 10. 3390/ molec ules2 42240 31
- Van Robertson WB, Schwartz B. Ascorbic acid and the formation of collagen. J Biol Chem 1953;201:689–96
- Viguet-Carrin S, Garnero P, Delmas PD (2006) The role of collagen in bone strength. Osteoporos Int 17(3):319–336. https:// doi. org/ 10. 1007/ s00198- 005- 2035-9
- Ferreira AM, Gentile P, Chiono V, Ciardelli G (2012) Collagen for bone tissue regeneration. Acta Biomater 8(9):3191–3200. https:// doi. org/ 10. 1016/j. actbio. 2012. 06. 014
- Garcia-Coronado JM, Martinez-Olvera L, Elizondo-Omana RE, Acosta-Olivo CA, Vilchez-Cavazos F, Simental-Mendia LE, Simental-Mendia M (2019)
- Effect of collagen supplementation on osteoarthritis symptoms: a meta-analysis of randomized placebo- controlled trials. Int Orthop 43(3):531–538. https:// doi. org/ 10. 1007/ s00264- 018- 4211-5
- Moskowitz RW (2000) Role of collagen hydrolysate in bone and joint disease. In: Seminars in arthritis and rheumatism, Vol. 30, No. 2. WB Saunders, pp 87–99
- Oesser S, Seifert J (2003) Stimulation of type II collagen biosynthesis and secretion in bovine chondrocytes cultured with degraded collagen. Cell Tissue Res 311(3):393–399. https:// doi. org/ 10. 1007/ s00441- 003- 0702-8
- Shaw G, Lee-Barthel A, Ross ML, Wang B, Baar K (2017) Vitamin C-enriched gelatin supplementation before intermittent activity augments collagen synthesis. Am J Clin Nutr 105(1):136–143. https:// doi. org/ 10. 3945/ ajcn. 116. 138594
- Lis DM, Baar K (2019) Effects of different vitamin C-enriched collagen derivatives on collagen synthesis. Int J Sport Nutr Exerc Metab 29(5):526–531. https:// doi. org/ 10. 1123/ ijsnem. 2018- 0385
- Oikawa SY, Kamal MJ, Webb EK, McGlory C, Baker SK, Phillips SM (2020a) Whey protein but not collagen peptides stimulate acute and longer-term muscle protein synthesis with and without resistance exercise in healthy older women: a randomized controlled trial. Am J Clin Nutr 111(3):708–718. https:// doi. org/ 10. 1093/ajcn/nqz332
- Shaw G, Lee-Barthel A, Ross ML, Wang B, Baar K (2017) Vitamin C-enriched gelatin supplementation before intermittent activity augments collagen synthesis. Am J Clin Nutr 105(1):136–143. https:// doi. org/ 10. 3945/ ajcn. 116. 138594
- Oikawa SY, Macinnis MJ, Tripp TR, McGlory C, Baker SK, Phillips SM (2020b) Lactalbumin, not collagen, augments muscle protein synthesis with aerobic exercise. Med Sci Sports Exerc 52(6):1394–1403. https:// doi. org/ 10. 1249/ mss. 00000 00000 002253
- Vitamin C-enriched gelatin supplementation before intermittent activity augments collagen synthesis; Gregory Shaw, Ann Lee-Barthel, Megan LR Ross, Bing Wang and Keith Baar, 2017
- Paxton JZ, Grover LM, Baar K (2010) Engineering an in vitro model of a functional ligament from bone to bone. Tissue Eng Part A 16(11):3515–3525. https:// doi. org/ 10. 1089/ ten. TEA. 2010. 0039
- McAlindon TE, Nuite M, Krishnan N, Ruthazer R, Price LL, Burstein D, Griffith J, Flechsenhar K. Change in knee osteoarthritis cartilage detected by delayed gadolinium enhanced magnetic resonance imaging following treatment with collagen hydrolysate: a pilot randomized controlled trial. Osteoarthritis Cartilage 2011;19:399–405
- Imaoka T, Suou T, Hirayama C. A simplified gelatin tolerance test to evaluate gastric and pancreatic proteolytic activities. Res Commun Chem Pathol Pharmacol 1992;78:97–108
- Langberg H, Rosendal L, Kjaer M. Training-induced changes in peritendinous type I collagen turnover determined by microdialysis in humans. J Physiol 2001;534:297–302. Miller BF, Hansen M, Olesen JL, Schwarz P, Babraj JA, Smith K, Rennie MJ, Kjaer M. Tendon collagen synthesis at rest and after exercise in women. J Appl Physiol (1985) 2007;102:541–6
- Bennell K, Hunter DJ, Vicenzino B (2012) Long-term effects of sport: preventing and managing OA in the athlete. Nat Rev Rheumatol 8(12):747–752
- Svensson RB, Heinemeier KM, Couppe C, Kjaer M, Magnusson SP (2016) Effect of aging and exercise on the tendon. J Appl Physiol (1985) 121(6):1237–1246. https:// doi. org/ 10. 1152/ jappl physi ol. 00328. 2016
- Frantz C, Stewart KM, Weaver VM (2010) The extracellular matrix at a glance. J Cell Sci 123(24):4195. https:// doi. org/ 10. 1242/ jcs. 023820
- Kannus P (2000) Structure of the tendon connective tissue. Scand J Med Sci Sports 10(6):312–320. https:// doi. org/ 10. 1034/j. 1600- 0838. 2000. 01000 6312.x
- Goes RA, Lopes LR, Cossich VRA, de Miranda VAR, Coelho ON, do Carmo Bastos R, Perini JA (2020) Musculoskeletal injuries in athletes from five modalities: a cross-sectional study. BMC Musculoskelet Disord 21(1):122. https:// doi. org/ 10. 1186/ s12891- 020- 3141-8
- Specific collagen peptides increase adaptions of patellar tendon morphology following 14-weeks of high-load resistance training: A randomized-controlled trial; Simon Jerger, Cristoph Centner, Benedikt Lauber, Olivier Seynnes, Till Friedrich, David Lolli, Albert Gollhofer and Daniel Konig
- Feng, M., & Betti, M. (2017). Transepithelial transport efficiency of bovine collagen hydrolysates in a human CaCo-2 cell line model. Food Chemistry, 224, 242–250. https://doi.org/10. 1016/j.foodchem.2016.12.044
- Wang, L., Wang, Q., Liang, Q., He, Y., Wang, Z., He, S., & Ma, H. (2015). Determination of bioavailability and identification of collagen peptide in blood after oral ingestion of gelatin. Journal of the Science of Food and Agriculture, 95(13), 2712–2717. https://doi.org/10.1002/jsfa.7008
- The effects of collagen peptide supplementation on body composition, collagen synthesis, and recovery from joint injury and exercise: a systematic review; Mishti Khatri, Robert J. Naughton, Tom Clifford, Liam D. Harper, Liam Corr
- Zdzieblik D, Oesser S, Gollhofer A, Konig D (2017) Improvement of activity-related knee joint discomfort following supplementation of specific collagen peptides. Appl Physiol Nutr Metab 42(6):588– 595. https:// doi. org/ 10. 1139/ apnm- 2016- 0390
- J Appl Physiol (1985) 121(6):1237–1246. https:// doi. org/ 10. 1152/ jappl physi ol. 00328. 2016
- Improvement of functional ankle properties following supplementation with specific collagen peptides in athletes with Chronic ankle instability, Patrick Dressler, Dominic Gehring, Denise Zdzieblik, Steffen Oesser, Albert Gollhofer and Daniel Konig
- Lopez HL, Ziegenfuss TN, Park J (2015) Evaluation of the effects of biocell collagen, a novel cartilage extract, on connective tissue support and functional recovery from exercise. Integr Med (encinitas) 14(3):30–38
- Clifford T, Ventress M, Allerton DM, Stansfield S, Tang JCY, Fraser WD, Stevenson E (2019) The effects of collagen peptides on muscle damage, inflammation and bone turnover following exercise: a randomized, controlled trial. Amino Acids 51(4):691–704. https:// doi. org/ 10. 1007/ s00726- 019- 02706-5
- Clark KL, Sebastianelli W, Flechsenhar KR, Aukermann DF, Meza F, Millard RL, Deitch JR, Sherbondy PS, Albert A. 24-Week study on the use of collagen hydrolysate as a dietary supplement in athletes with activity-related joint pain. Curr Med Res Opin 2008;24:1485–96
- Joonsung Lee, Josh E. Bridge, David R. Clark, Claire E. Stewart and Robert M. Erskine; Collagen supplementation augments changes in patellar tendon properties in female soccer players 26 january 2023
- Ricard-Blum S (2011) The collagen family. Cold Spring Harb Perspect Biol 3(1):a004978. https:// doi. org/ 10. 1101/ cshpe rspect. a0049 78
- Leon-Lopez A, Morales-Penaloza A, Martinez-Juarez VM, Vargas- Torres A, Zeugolis DI, Aguirre-Alvarez G (2019) Hydrolyzed collagen-sources and applications. Molecules. https:// doi. org/ 10. 3390/ molec ules2 42240 31
- Van Robertson WB, Schwartz B. Ascorbic acid and the formation of collagen. J Biol Chem 1953;201:689–96


